期刊封面

[文献]硫酸乙酰肝素蛋白聚糖在胶质母细胞瘤肿瘤微环境中的作用研究进展 |纪
硫酸乙酰肝素蛋白聚糖在胶质母细胞瘤肿瘤微环境中的作用研究进展
本文作者:北京大学医学部基础医学院病理系、第三医院病理科纪青、常青;本文发表在2017年第7期《转化医学电子杂志》上;神外前沿转载此文已获该杂志授权;
摘要:
胶质母细胞瘤(GBM)是一种呈弥漫性生长的高度 恶性胶质细胞瘤. 肿瘤微环境在 GBM 的生长中起重要作用.硫酸乙酰肝素蛋白聚糖(HSPG)是 GBM 肿瘤微环境中的重要 成分之一.它通过与不同蛋白配体的相互作用,可以调控一系 列配体介导的信号通路,通过对肿瘤细胞、血管内皮细胞以及 免疫细胞的不同作用来促进 GBM 的形成和发展. HSPG 的修 饰酶,HPSE 和 SULF,也可以通过对 HSPG 上硫酸乙酰肝素黏 多糖链的修饰作用来调节相关细胞信号通路,调节肿瘤的生 长. 在前神经元型和间质型 GBM 中,HSPG 及其修饰酶的表达有明显的差异性,以其在 GBM 中的亚型特异性为基础,发 展针对不同亚型的特异性治疗将有利于改善患者的治疗效 果.正在开展的以 HSPG 为治疗靶点的 PG545、OKN?007、 M402 和 SST0001 等药物的相关临床前研究将为 GBM 患者开 展精准治疗提供新策略.
引言
胶质母细胞瘤(glioblastoma, GBM)是一种呈弥漫性生长的高度恶性胶质细胞瘤. 它是成人中最常 见的一种恶性脑肿瘤. 在 WHO 2016 版中枢神经系 统肿瘤分类中,GBM 被分为 IDH 野生型、IDH 突变型 和 NOS 型. 最新研究表明,以 IDH1 基因为靶点治疗 白血病有良好的效果[1] . 但是 IDH 抑制剂 AG?120 和 AG221 治疗 IDH 突变型胶质瘤尚未得到理想的三期 临床试验结果,仍需深入探索相关的分子机制,从而 改善治疗方案,取得更佳治疗效果[2] .
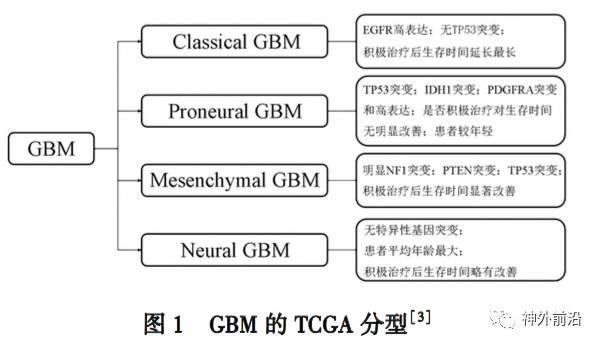
与 WHO 分 型 不 同, The Cancer Genome Atlas (TCGA)的研究者基于患者年龄、预后、基因型及积 极治疗的效果,将 GBM 进一步分为四个亚型,分别为 经典型(classical)、前神经元型(proneual)、间质型 (mesenchymal)和神经元型(neural)[3] . 不同亚型受 不同信号通路的调控(图 1). 有研究者发现,在以 PDGFR 信号通路改变为特征的前神经元型 GBM 中, 硫酸酯酶 2(sulfatase 2, SULF 2)有较高表达[4] . 而间 质型 GBM 中乙酰肝素酶(heparanase, HPSE)的表达 最多,并且多个硫酸乙酰肝素蛋白聚糖(heparan sul? fate proteoglycan, HSPG)相关基因的表达也有所增 加[5] . 而前二者(SULF2 和 HPSE)是后者(HSPG)的 修饰酶.
有研究表明,GBM 的发生与肿瘤微环境(tumor microenvironment, TME) 关系密切[6-7] . TME 由肿瘤 周围细胞及包括肿瘤细胞在内的所有细胞分泌的各 种可溶性因子构成. TME 提供了一个促肿瘤形成的 环境,使肿瘤和非肿瘤细胞的各种代谢反应发生改 变,从而帮助肿瘤组织与非肿瘤组织竞争营养物质及 其缺乏的相关分子,使肿瘤组织即使在缺氧的环境下 也能继续生长[8] . 此外,肿瘤微环境中的这些代谢异 常还能抑制针对肿瘤细胞的免疫反应,并帮助肿瘤组 织抵抗治疗[10] .
HSPG 是肿瘤微环境中的一种重要蛋白,与 GBM 的发展密切相关[6-7] . HSPG 及其修饰酶通过与肿瘤 微环境中不同信号分子的相互作用调控相关信号通 路,改变肿瘤周围的代谢反应. 而 HSPG 修饰酶在 GBM 不同亚型中的差异性表达提示 HSPG 可能具有 GBM 亚型特异性.基于 HSPG 在肿瘤微环境中的重 要作用,有望发展出针对不同亚型 GBM 的特异性分 子诊断和治疗方法,改善 GBM 的治疗效果.
本文将从 HSPG 的功能到其与肿瘤微环境的关 系展开讨论,探讨 HSPG 在 GBM 临床诊断与治疗中 的应用前景.
1.HSPG 在人类肿瘤中的生物学功能
HSPG 是一种蛋白聚糖,由一个核心蛋白和与核心蛋白相连的 HS 粘多糖链组成. Protein Atlas 数据库显示,HSPG 广泛存在于多个人体器官和组织的细胞中,在小脑、骨髓、心肌、乳腺、前列腺等器官和脂肪组织以及软组织中均有较高表达,是正常脑组织和GBM 中主要的细胞外环境成分[9-11] . 通过结合生长因子、趋化因子、成形素(morphogens)、基质蛋白、细胞粘附分子和蛋白酶等蛋白配体,如核转录因子 κB(nuclear factor of κB, NF?κB)、 血 小 板 生 长 因 子(platelet?derived growth factor, PDGF)、 成纤维母细胞生长因子(fibroblast growth factor, FGF)等,HSPG可以阻断配体与其受体结合,防止其接触同源受体以减少信号传播,或者作为信号传播的共同受体促进信号传播,从而发挥调节细胞增殖、迁移和粘附的 功能[9-14] .
以分泌蛋白 Wnt 家族的细胞外调控为例,从细 胞中释放后,Wnt 配体会被 HSPG 等细胞外蛋白结合 并隔离,只有当配体从 HSPG 上释放时,才可以结合 并激活 Frizzled 受体[14] ,从而发挥其调节细胞增殖的 作用. 而另一方面,HSPG 也可以作为配体介导的信 号通路的共同受体来促进信号的传播,例如具有细胞 增殖、存活、迁移和分化等广泛的生物学效应的 FGF信号通路. 在这一信号通路中,HSPG 就起到了稳定 FGF 配体受体复合物的作用[15-18] .
文章来源:《航空航天医学杂志》 网址: http://www.hkhtyxzz.cn/zonghexinwen/2020/0819/448.html
上一篇:腾讯天衍实验室郑冶枫:医学影像AI为什么需要小样本学习和域自适应技术?
下一篇:《美国医学会杂志》:HIV携带者吸烟死于肺癌可能性比艾滋病本身高10倍